【乐美好医】AACR 2018 | 癌症前沿的回顾与展望(下)
声明:本文来自于【乐美好医】公众号 作者:song
摘要:
美国癌症研究协会年会(AACR)于2018年4月14日至18日在芝加哥举行,吸引了近2万名全球的癌症科研和临床研究专家与会。大会发布了大量突破性的进展,覆盖最新的基础、转化、临床和预防的研究成果,其中肿瘤免疫疗法、细胞治疗仍然是最热门的主题,液体活检和单细胞基因组学的进展也受到关注!

大会亮点
本次AACR年会上,多家公司和研究小组发布了最新的进展。上篇已经总结了免疫肿瘤的相关临床研究进展,详情戳这里。本篇继续对AACR大会进行总结,涉及的内容包括:
- 细胞治疗
- 生物标记物
- 液体活检
- 液体活检+肿瘤免疫
- CTC技术和应用
- 单细胞基因组学
#细胞治疗
2017年2款CAR-T产品获批,开启了肿瘤治疗的新纪元,2018 AACR更多细胞疗法成果展现,并和基因编辑等技术结合,开始解决不能应用于实体瘤等问题。

CRISPR Therapeutics是一家致力于为严重疾病创造转基因药物的生物制药公司,其首席执行官Samarth Kulkarni认为,细胞疗法的未来在于能够通过将多种修饰与精确性,一致性相结合来创建更复杂的CAR-Ts细胞。基于CRISPR的基因编辑将成为实现下一代CAR-Ts的引擎。
在AACR年会上公布该公司异基因嵌合抗原受体T细胞(CAR-T)项目的新数据,该项目通过CRISPR/Cas9基因编辑产生靶向B细胞成熟抗原(BCMA)和CD70的CAR-T细胞,其具有编辑速率高、表达一致,选择性高,能有效杀伤靶细胞等特点。这些数据证实并扩展了该公司的CAR-T计划(CTX101)。该公司运用CRISPR引领的异基因CAR-T细胞治疗技术正在开发用于CD19 +恶性肿瘤的药物。(Poster 1540 & Poster 2551)

Fate Therapeutics 是一家临床阶段生物制药公司,致力于癌症和免疫疾病的程序化细胞免疫治疗的开发,该公司也在AACR年会上发布了FT819的新临床前数据。
FT819是由诱导多能干细胞(iPSC)产生的CAR-T细胞候选产物。FT819具有两种靶向受体,一种靶向CD19阳性肿瘤细胞的嵌合抗原受体(CAR)和一种CD16 Fc受体,其可以与其他已证实的癌症治疗(例如基于肿瘤抗原靶向单克隆抗体(mAb)的治疗)结合以克服抗原逃逸。
用于生产FT819的主iPSC细胞系在一次性工程化,将CAR19插入到T细胞受体α恒定(TRAC)基因座中以增强安全性和效力并完全消除T细胞受体(TCR)表达。该生产线可作为可持续和反复生产同种细胞产品的可再生资源,可支持成千上万的患者以现成的方式进行治疗。这种方法消除了从患者自己的细胞创建个性化治疗的需要,实现了大规模生产,并显着降低了患者治疗的成本和时间。

OncoSec Medical 公司是一家开发瘤内免疫疗法的公司。正在开发基于DNA的瘤内免疫疗法,并采用ImmunoPulse®治疗癌症的研究技术。ImmunoPulse设计用于增强局部递送和摄取基于DNA的免疫靶向剂,如质粒编码的IL-12(tavokinogene telseplasmid或“tavo”)。其针对转移性“三阴”乳腺癌(TNBC)患者的OMS-I140临床试验数据已被选定在AACR上进行口头报告。
“三阴”乳腺癌(TNBC)是一种高度侵袭性的乳腺癌,通常使用化疗方法治疗,但是复发率高,肿瘤细胞耐药现象严重。而免疫治疗则被认为是治愈TNBC的有效方法。科学家希望通过生物工程学构建CAR-T细胞,使其分泌大量的免疫调控抗体从而治疗TNBC。科学家们希望通过构建双特异性CAR,靶向TNBC上的两个抗原,从而缓解脱靶效应,同时分泌监测点阻断蛋白,以此来去除肿瘤微环境中的抑制作用。通过对局部免疫的重建,CAR-T细胞和其他肿瘤微环境中的细胞一起清除肿瘤细胞,治愈癌症。
CAR-T细胞疗法就是通过输入基因工程构建的嵌合抗体T细胞指导患者体内的T细胞杀死肿瘤细胞。而细胞的嵌合受体——CAR是一个连接T细胞受体和共受体的细胞内信号结构域与抗原识别区的穿膜蛋白。
而与血液肿瘤不同,实体瘤相关的靶蛋白在肿瘤细胞和正常组织中都大量的表达,从而造成CAR-T治疗过程中的严重脱靶效应。并且肿瘤微环境中的免疫抑制限制了CAR-T细胞杀死肿瘤细胞的能力。

重新调整内源性免疫途径以改善嵌合抗原受体T细胞效力
Cellectis公司采用整合在调控PD1或CD25的内源启动子控制下的IL-12嵌合异源二聚体的策略,对CAR T细胞的细胞因子分泌进行了改造。两种基因在CAR T细胞与肿瘤接合后被激活,它们可用于仅在给定肿瘤附近分泌细胞因子。这种方法将减少由其全身分泌引起的潜在副作用,同时保持其改善抗肿瘤活性的能力。
异体CD123 CAR T细胞治疗突发性浆细胞样树突状细胞肿瘤(BPDCN)临床前疗效研究
Blastic浆细胞样树突状细胞肿瘤(BPDCN)是一种罕见的侵袭性血液系统恶性肿瘤。BPDCN患者CD123过度表达率近100%,因此,CD123可能成为治疗该疾病的重要靶标。UCART123使用含有抗CD123 CAR和RQR8耗竭配体的遗传修饰的同种异体T细胞,其赋予对利妥昔单抗的易感性。使用Cellectis的TALEN基因编辑技术,通过失活TCRα恒定基因消除了T细胞受体(TCR)的表达。在BPDCN PDX模型中,UCART123 可以根除BPDCN或者达到长期无病生存状态。
通过多模式评估最小残留疾病和同种异体抗CD123 CAR T细胞(UCART123)持续存在于急性髓细胞性白血病的临床前模型中预测免疫治疗结果
对于急性骨髓性白血病(AML)在内的肿瘤,关于CAR-T技术的输注和再输注方案的临床指导并不清楚,而预测微小残留病(MRD)评估可以预测AML复发。Cellectis试图确定MRD标记物和CAR-T特异性标记物的同时评估是否可以确定CAR-T给药剂量和再输液方案。Cellectis建立了CD123 CAR-T细胞(UCART123)的PDX模型测试了这种方法,在针对AML的UCART123的 I期临床试验中,实施了ddPCR测定,从而同时检测NPM1突变型AML患者的外周血中的UCART123细胞和原始细胞。
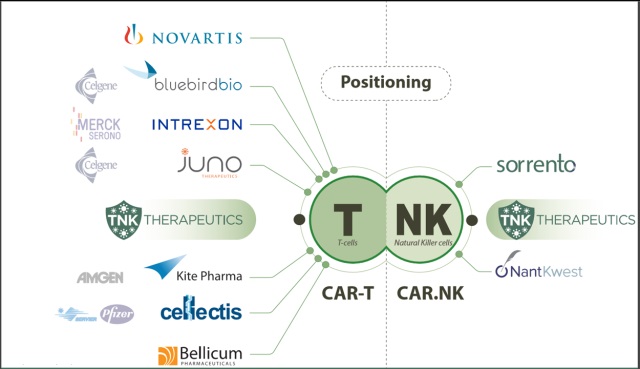
(Source: Sorrento Theraputics)
CAR NK细胞有望成为未来治疗癌症的主力
嵌合抗原受体(Chimeric antigen receptor,CAR)T细胞能够有效的治疗血液肿瘤,胶质瘤以及一些实体瘤。但是CAR-T治疗会给一些患者带来致死的副作用,例如细胞因子释放综合征,脱靶效应,神经毒性。但是CAR 自然杀伤(NK)细胞相对于CAR-T细胞在治疗时就会安全许多,这是由于NK细胞缺乏克隆性增殖的能力,并且具有发展成为“现成”CAR细胞的能力。
为了深入研究CAR NK细胞,科学家在临床前实验中构建了特异性靶向CS1位点的CAR-T和CAR NK细胞。CS1位点存在于95%的多发性骨髓瘤患者的所有肿瘤细胞中。而靶向CS1的CAR-T和CAR NK细胞都具有十分显著的治疗效果,并且显著的延长了带瘤小鼠的生存期。
同时,科学家还使携带caspase-9自杀基因的CAR-T和CAR NK细胞靶向FLT3来治疗急性髓系白血病(AML)。而在胶质瘤治疗的研究中,科学家使用CAR NK细胞靶向共表达与胶质瘤细胞表面的野生型EGFR和突变型EGFR Ⅷ,也取得了很好的效果。
#生物标志物
关于生物标志物测试的争议,PD-L1的必要性得到重申,其他检测如TMB等的重要性也得以证明,可能成为免疫治疗疗效的潜在标志物。

耶鲁大学癌症中心教授
Roy Herbst博士
生物标志物测试是临床试验中检验方案有效性的重要环节。但是业内人士常抱怨PD-L1作为免疫疗法的生物标志效果不佳;Merck的联合疗法临床项目显示疗效和PD-L1没有明显关系,因此,给药前进行该测试必要性产生了一定的争议。
面对这一争议,在关于KEYNOTE-189的讨论报告中,Roy Herbst博士重申了PD-L1检测的必要性。根据PD-L1的表达量,可以用来指导患者选择联合治疗或者单药治疗。随后的大会报告还讨论了对于PD-L1表达 <1%的人群潜在的免疫治疗方案。从现场的讨论结果来看,PD-L1测试将不会减少,仍是在为患者决策是否使用PD-1 / PD-L1免疫疗法的最佳工具之一。
肿瘤突变负荷(Tumor mutation burden, TMB)是有另一个有代表性的生物标志物。研究发现肿瘤细胞内的基因突变数量越多,产生的异常抗原就会越多,也越有可能“被免疫治疗”。因此,TMB成为预测PD-1/PD-L1免疫治疗疗效的潜在标志物。BMS的试验数据也证实了TMB作为肿瘤免疫疗法生物标志物的临床价值。与PD-L1一起,TMB是临床医生可以用于患者给药分类的有效工具。
目前,TMB如何作为临床应用的生物标志物尚待确定。比如在肺癌领域,一种观点是和EGFR、ALK、PD-L1一样作为主要标志物,另外一种观点是作为次要标记物和效果测试来区分PD-L1-患者。参与讨论的专家还主张TMB检测可以作为衡量肺癌治疗和管理的标准。
我们将继续关注TMB最终以怎样的方式在临床指南被采用,或者其在肿瘤治疗领域被接纳。
#液体活检
液体活检发展势头依旧迅猛,和其他领域的紧密结合。
液体活检捕获到进入血液的细胞或DNA,从而进行疾病的诊断。液体活检与组织检测相比优势在于:方便,快速,即时,便宜,微创。
只需通过简单的一滴血,肿瘤学家就能快速确定治疗方案,并提供继续监测该治疗方案的有效性,发现耐药性尽早尝试替代方案。
《柳叶刀》肿瘤子刊近期发表了美国国家癌症中心对126位淋巴瘤患者进行的研究,结果表明液体活检能比CT扫描提前3个月预测出肿瘤复发。

纽约斯隆-凯特林癌症中心教授
David Hyman博士
液体活检主要分别为血浆游离DNA(cfDNA)、循环肿瘤DNA(ctDNA)、循环肿瘤细胞(CTC) 检测。纽约斯隆-凯特林癌症中心肿瘤学家David Hyman称:“每种癌症都会有一个突变,都可以利用该方法来追踪。这就好比是癌症在血液中的条形码。” 要发现这小段DNA并不是一件容易的事情,因为它们在血流中只能维持2个小时之后就会被新陈代谢掉。
有研究证实,肿瘤患者外周血中的DNA总量要高于健康人。可以通过 cfDNA的含量增多作为一个初筛的手段。循环肿瘤DNA(ctDNA)是死亡的肿瘤细胞破裂后所释放出来的、片段化的基因组DNA。属于cfDNA的一种类型,ctDNA仅为cfDNA很小的一部分。
#液体活检+肿瘤免疫
液体活检发展势头依旧迅猛。免疫肿瘤延伸到液体活检是今年的AACR中值得注意的主要趋势之一。对液体活检相关的研究摘要进行分析,有超过10%的研究是针对TMB,微卫星不稳定性(MSI)、PD-L1。许多研究都试图克服把这些概念从组织应用延伸到血液检测时面临的挑战。因为 ctDNA比组织来源的DNA要短,并且野生型DNA的信号可能干扰相关变异的检测
美国PGDx公司的报道展示了一种对MSI结果纠错;纽约斯隆凯特琳癌症中心(MSKCC)主要着眼于MSK-IMPACT组织测试和MSK-Access cfDNA血液测试之间的一致性; 美国Foundation Medicine公司(已纳入美国医保的癌症筛查,戳这里)试图证实血液肿瘤突变负荷(bTMB)检测的临床实用性; 西北大学使用Guardant360进行bTMB分析实验。

MSKCC研发的基于高通量测序技术的肿瘤多基因性能检测试剂MSK-IMPACT,2017年11月15日由美国FDA批准上市
MSK- MPACT是一种基于高通测序检测原理,用于检测福尔马林固定的石蜡包埋的肿瘤组织样本中468种基因突变及遗传变异。样本来源于实体瘤患者人群,可检测包含点突变,小插入和缺失和微卫星不稳定性。
该产品作为一种肿瘤靶标的综合突变分析产品,明确不用于伴随诊断用途,仅供MSKCC有资质的专业入员根据专业指南进行使用。纪念Sloan-Kattering癌症中心(MSKCC)的壁报主要着眼于MSK-IMPACT组织测试和MSK-Access cfDNA血液测试之间的一致性
#CTC技术和应用
循环肿瘤细胞(CTC)是指从实体瘤中脱离出来并进入外周血液循环的肿瘤细胞。普通健康人中 cfDNA含量低,超过90%的健康个体每毫升血浆中的cDNA量不超过25ng,而患者的cfDNA水平是健康人的数倍。 ctDNA的灵敏度高于CTC,但针对肿瘤早期筛查或诊断,CTC的准确性优于 ctDNA。

CTC技术和应用正在迅速增长。该领域正从纯粹的CTC计数转向更复杂的基因型和表型分析(包括PD-L1)。因此,CellMax Life,Celsee,Vortex Biosciences,MiCareo和RareCyte等许多小公司正在推进新方法来分离和分析CTC。这些公司需要迅速采取行动来证明技术的有效性和实用性。
谁在该领域领先目前似乎还不清楚,但我们将密切关注这个领域,因为CTC在肿瘤检测中的准确性是无可比拟的。
#单细胞基因组学
单细胞基因组学(SCG)也一直是近年来基因组学热门领域,多家公司推出了各种单细胞分析系统。今年有30多个研究提到SCG。

10x Genomics平台仍然在SCG领域占据主导地位 - 今年30多篇摘要中提到了10x Genomics。在会议上,他们推出了一种新的解决方案,将其单细胞服务扩大到单细胞DNA检测,占了30篇文摘中的10篇。其中一个重点是了解肿瘤异质性,肿瘤微环境和异常的DNA拷贝数变化(CNV)。由于10x Genomics是单细胞RNA测序领域的领导者,因此它充分利用了I/O疗法的优势。其利用单细胞ATAC-seq和特征条形码进行多组学分析进一步扩展到表观遗传学,它们在整个癌症研究和转化医学领域都处于领先地位。

Mission Bio公司更专注于DNA测序的临床应用,多个研究中心采用了其去年10月推出以Tapestri平台。该平台可用于单细胞DNA测序(最多10K细胞),目前有3个多组合检测可用。DNA由于分子更稳定,因此可能在临床中更受欢迎,与I / O相比,靶向治疗仍然是市场的主体,并且> 1,500个临床试验使用组合疗法。
尽管平台技术的进步以及越来越多的新应用和分析(例如RAS驱动的FLT3突变克隆),杀手应用程序未建立。此外,与石蜡切片(FFPE)相比,制备新鲜冷冻组织用于固体肿瘤分析在临床条件下是个难点。FFPE兼容性是单细胞分析领域差异化的重要机遇,也是与临床衔接的关键。与此同时,我们仍然期望在中转化研究中越来越多地采用单细胞分析。

Fluidigm公司增加了质量流式细胞仪和成像质量流式细胞术的吸引力。在单细胞静脉中,我们也注意到使用质量流式细胞仪增加单细胞的高参数分析。有超过25篇摘要突出了该技术的使用,新的Hyperion成像系统在亚细胞分辨率(〜1um)下对于组织和肿瘤(包括FFPE)中的蛋白质生物标志物的鉴别很有优势。该解决方案能够分析细胞表型,在组织微环境内细胞间相互作用和相互关系。
结语:
免疫肿瘤治疗是已经迈入临床拓展适应症和联合给药阶段;肿瘤细胞治疗正在蓬勃发展,不断突破技术瓶颈;生物标志物和液体活检依旧是热门话题,试图为癌症治疗的诊断,检查提供更权威可靠的指标和方法。AACR最为全球癌症治疗的重要会议,涵盖了癌症治疗各项研究前沿,小编仅摘取了会议中的一部分内容进行介绍,感兴趣的读者可以关注AACR的官方网站以及加乐美助理(微信号:lemeizhuli)索要AACR年度进展报告。

特别声明
本文系2018 AACR年会总结,内容来源来自AACR等权威机构,详见参考文献列表,经整理评论旨在传播肿瘤方面最尖端的医学和最前沿的进展,内容仅供研究参考使用,任何人不得使用文中内容或者公众号其他内容供临床使用。鸣谢耶鲁大学肿瘤免疫专家王俊博士和国立卫生研究院陈龙博士协助审稿和策划。
合作请联系乐美助理(微信号:lemeizhuli)。
数据来源:
1. AACR官方网站
2. AACR Cancer Progress Report 2017
3. MERCK、ROCHE、BMS等制药公司
4. PGDx,10x Genomics,Mission Bio 等检测公司官方网站
2. Rizvi N. Hellmann M. Synder A. Mutational landscape determines sensitivity to PD-1 blockade in non–small cell lung cancer. Science. 2015 Apr 3; 348(6230): 124–128
3. Le D. Uram J. Wang H. et al. PD-1 Blockade in tumors with mismatch-repair deficiency. N Engl J Med 2015; 372:2509-2520
热门文章
版权声明:本平台所有注明“原创”的作品,版权归“医牛”所有,未经书面授权,任何媒体、网站和个人禁止进行转载、摘编、复制等任何使用,未经授权使用将承担相应法律责任。授权转载时须注明“来源; 医牛健康资讯网”。本平台所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。图片均来自于网络,版权属于原作者。
